单细胞和空间多组学在肿瘤微环境研究方向主要为:绘制肿瘤组织的空间结构和组成、肿瘤与微环境互作、免疫逃逸、肿瘤扩散、转移及空间标志物。分析思路大致分为两种,第一种是单细胞为主,空转为辅,即利用单细胞测序发现感兴趣的细胞类型或细胞类型间互作后补充空间转录组进行验证补充;二是空转为主,单细胞为辅,即利用空间转录组测序探索发现感兴趣的目标区域和细胞类型后补充单细胞数据进行验证和精确注释。今天小编为大家分享空转为主、单细胞为辅的研究思路如何应用于肿瘤微环境研究。

空间转录组揭示人类肝癌浸润区促进肝细胞-肿瘤细胞串扰、局部免疫抑制和肿瘤进展
An Invasive Zone in Human Liver Cancer Identifified by Stereo-seq Promotes Hepatocyte–Tumor Cell Crosstalk, Local Immunosuppression and Tumor Progression
期刊:Cell Research(IF=46.2)
年份:2023
研究者(Wu et al., 2023)利用单细胞转录组及空间转录组重点解析肝癌患者肿瘤边界为中心的500 μm宽区域的 “侵袭区”。在该区域出现一群强免疫抑制、代谢重编程和严重受损的SAA+肝细胞。此外,该肝细胞群在侵袭区血清淀粉样蛋白 A1和 A2(SAAs)可导致巨噬细胞募集和M2极化,进一步促进局部免疫抑制,可能导致肿瘤进展。

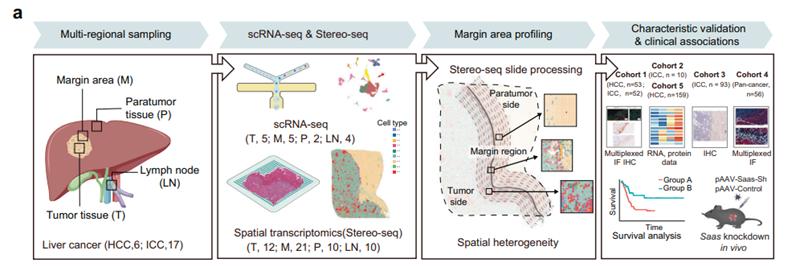
图1 技术路线图
注:空间转录组样本选择为21例病理诊断为原发性肝癌的患者(6例HCC 肝细胞癌,15例ICC肝内胆管细胞癌)中的53份新鲜或新鲜冷冻样本(包括12份肿瘤组织(T),21份肿瘤边界组织(M),10份癌旁组织(P),10份淋巴结转移组织(LN)),共计98张切片;单细胞转录组样本选择为5例原发性肝癌患者(1例HCC,4例ICC)的16份样本(5份T,5份M,2份P,4份LN)

01 原发性人肝癌多个区域位点的空间分辨转录组学谱
研究者将获取的不同肝癌患者的肿瘤组织、肿瘤边界组织、癌旁组织和淋巴结转移组织进行空间转录组测序,聚类分析注释将这些细胞划分为九种主要的细胞类型,B细胞、浆细胞、巨噬细胞、树突状细胞、肝细胞、内皮细胞、成纤维细胞等(图2d)。在4个区域(T、M、P和LN)中,细胞组成和空间分布具有高度异质性(图2a)。在空间维度上观察,发现巨噬细胞等免疫细胞主要在边缘区域的肿瘤边界周围积聚(图2a),表明边界周围具有独特的免疫微环境。
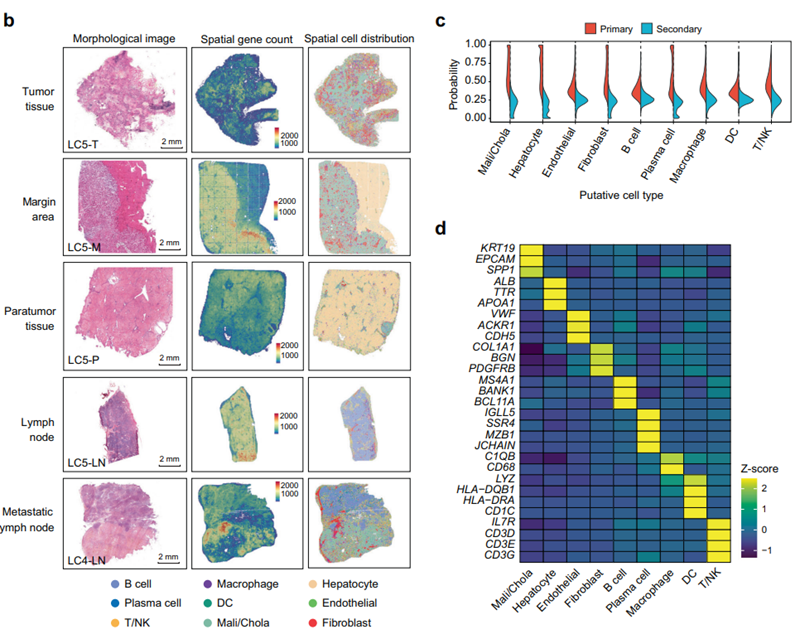
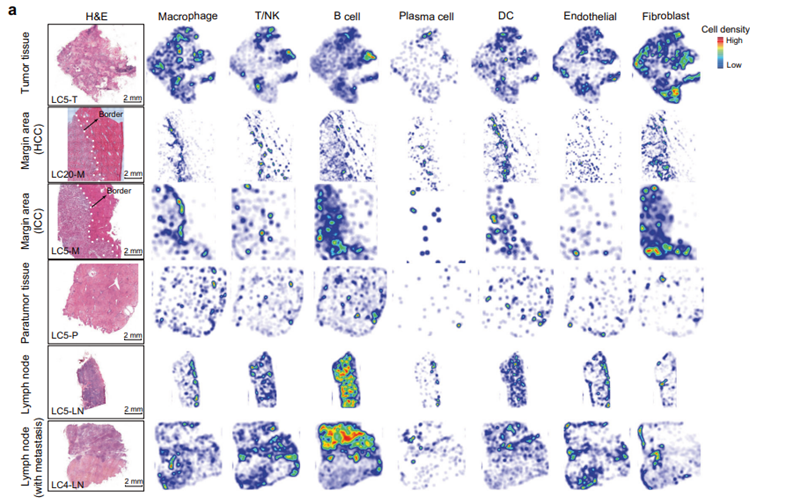
图2 人类原发性肝癌四个组织区域的空间转录异质性
02 肿瘤边界“侵袭区”的生物学特征
研究者通过扫描数字化模型(SDM)来进一步研究肿瘤侵袭边界区域两侧的特征(图3a),确定了一个独特的侵袭区域(以肿瘤边界两侧为中心的500 µm宽的区域),并定义为“侵袭前沿”,具有免疫抑制环境占主导地位、脂肪酸代谢能量供应增加、肿瘤细胞上皮-间质转化能力增强,以及肝细胞严重受损的特点(图3e、3f和3g)。
研究人员进一步解析侵袭区沿边界切线方向的细胞多样性和状态,发现与亚区域其他细胞组成模式相比,肿瘤复发患者中显著富集巨噬细胞,提示浸润区域中巨噬细胞可能是肿瘤进展的关键因素(图3b和3d)。
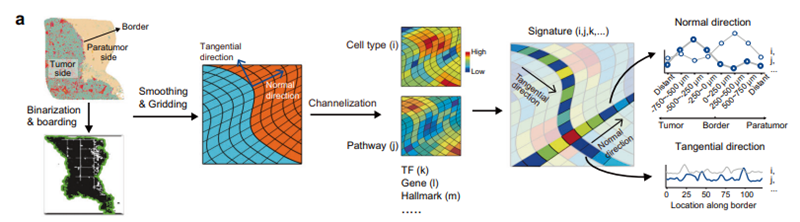
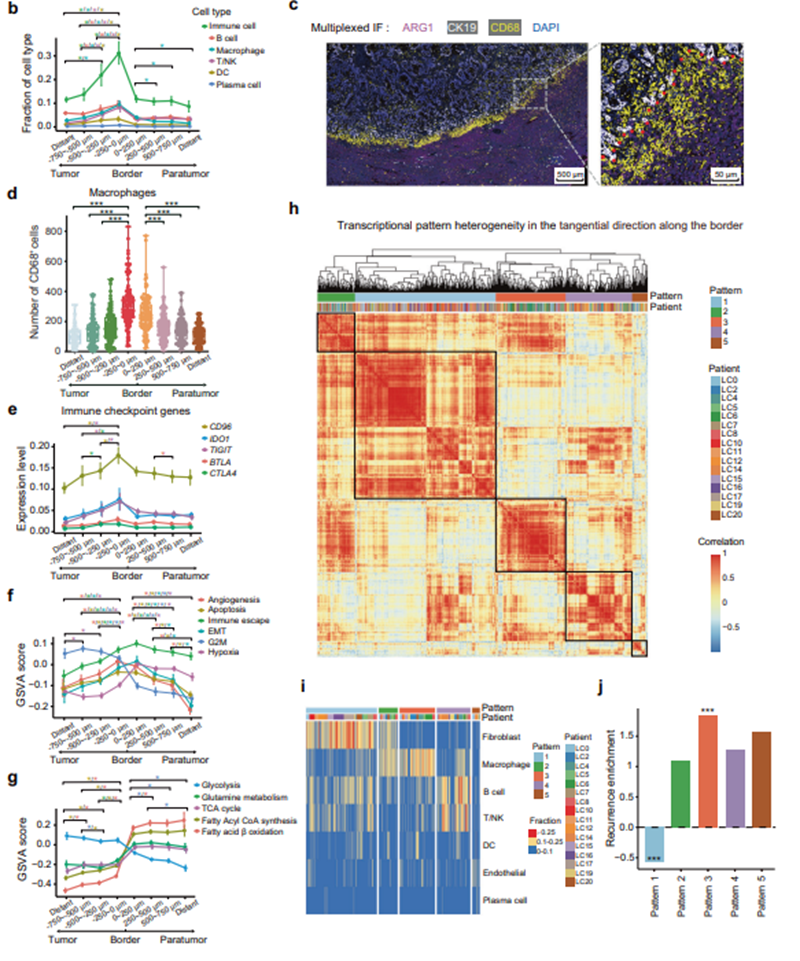
图3 沿肿瘤边界的切向和法线方向的特征
03 侵袭区JAK-STAT3激活诱导受损肝细胞亚型SAAs的高表达
为进一步表征肝细胞的炎症反应及这种反应在肿瘤侵袭中的作用,研究人员将来自肿瘤旁侧三层(0~250 µm、250~500 µm和500~750 µm区域)的肝细胞重新聚类,鉴定了两种肝细胞亚型(Hep1和Hep2),其中Hep1表现出更高的SAA1和SAA2(血清淀粉样蛋白A1和A2;统称为SAAs)表达水平,并显著富集在最靠近肿瘤旁边界的 250 µm宽区域内(图4a、4b)。研究人员通过进一步分析组织切片中接近Hep1富集区域和其余区域的肿瘤细胞之间的差异基因表达,确认肝癌肿瘤细胞可以通过分泌CXCL6并随后在侵袭区激活JAK-STAT3通路来诱导肝细胞中 SAAs的过表达(图4f~4l)。
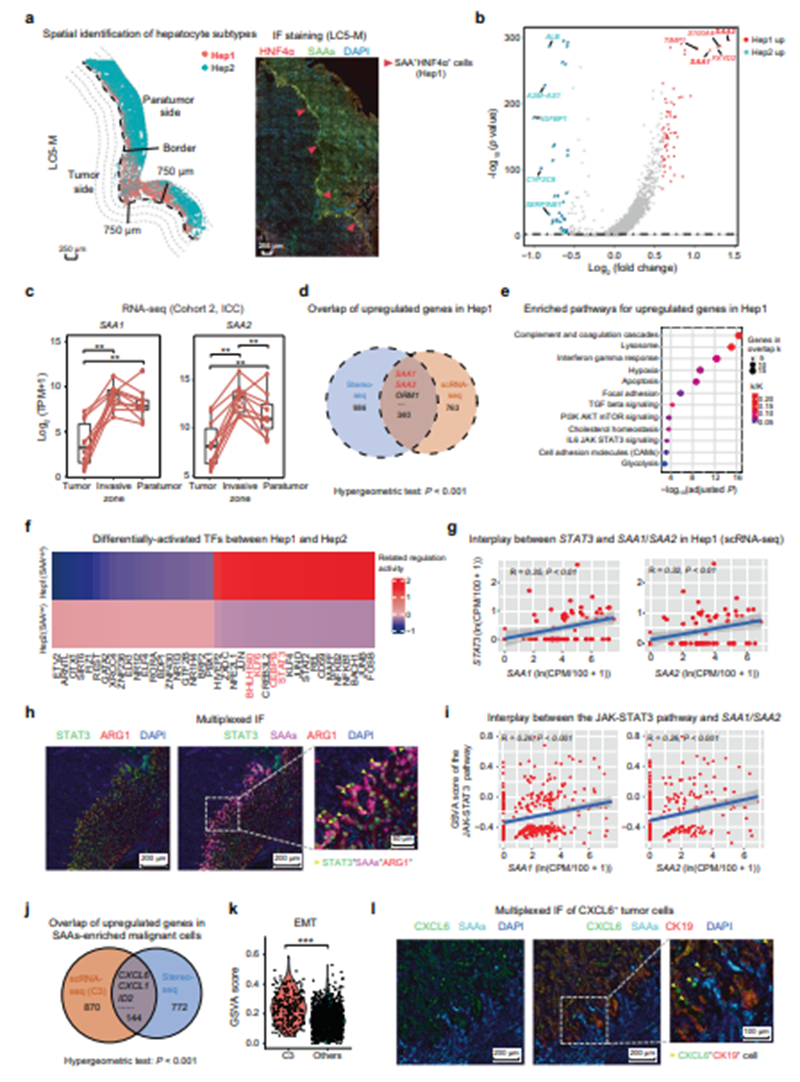
图4 侵袭区JAK-STAT3激活诱导高表达SAAs的肝细胞的区域特异性损伤
04 SAAs+肝细胞亚型有助于巨噬细胞的募集和M2极化
为了探索侵袭区中SAAs+肝细胞(Hep1)的功能,研究人员基于边缘区域的scRNA-seq数据,细胞通讯分析后发现在肝细胞和巨噬细胞之间观察到最强的双向通讯,有超过25个显著相互作用的配体-受体对(图5a)。表达SAAs受体编码基因的巨噬细胞在空间上富集在侵袭区Hep1亚型细胞附近,进一步定量分析显示,SAAs受体+巨噬细胞在第一层(距肿瘤边界0~250 µm)肿瘤侧富集,这支持侵袭区受损肝细胞通过分泌SAAs来募集巨噬细胞(图5b~5f)。
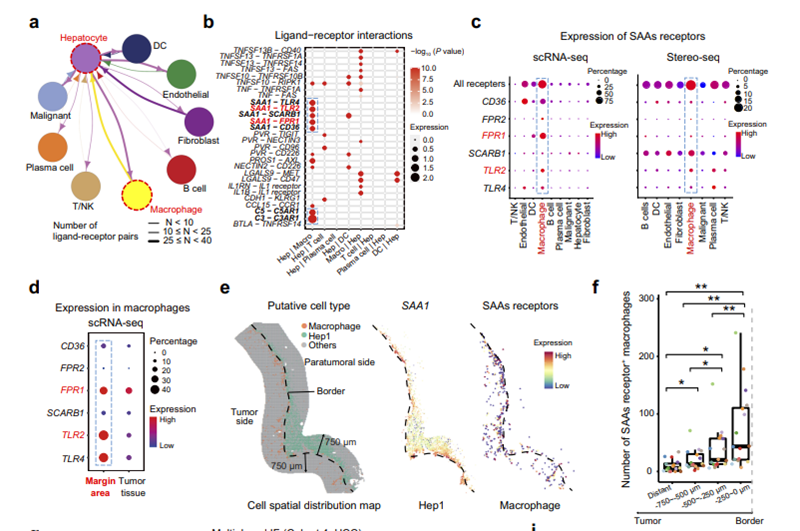
图5 受损肝细胞中CXCR2与侵袭区CXCL6+肿瘤细胞间相互作用诱导SAAs高表达
05 SAAs+肝细胞亚型与肿瘤进展相关
研究人员探讨了受损肝细胞和侵袭区募集的巨噬细胞的临床意义。结果显示,侵袭区高比例的SAAs+肝细胞与原发性肝癌和继发性肝癌患者的不良预后显著相关(图6c、6d)。为验证是否能通过调控SAAs的表达来控制肿瘤细胞的进展和侵袭,研究人员利用小鼠原位肝癌和肠癌肝转移模型,在体内特异性转染以降低正常肝细胞的SAAs表达,发现可以减少侵袭区巨噬细胞富集程度,同时肿瘤生长也得以延缓(图6e~6f)。
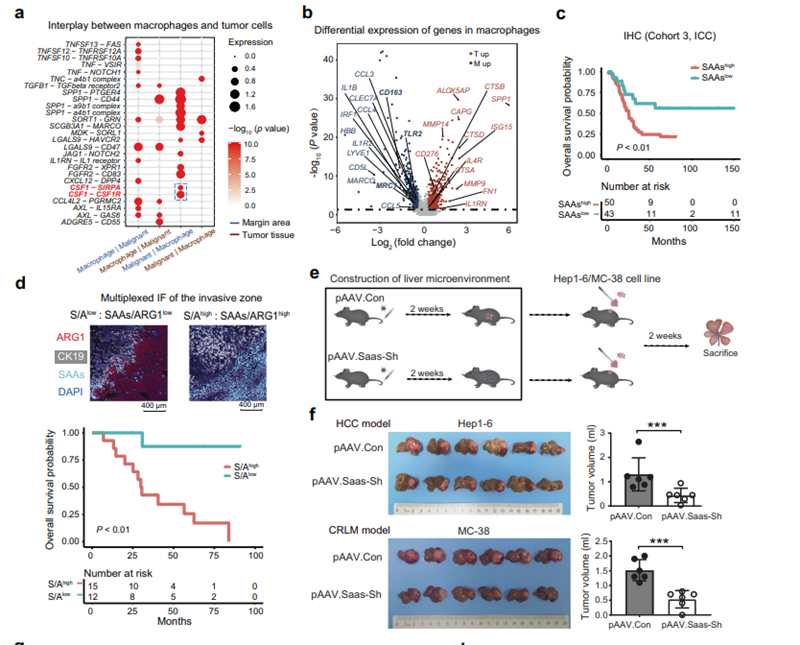
图6 SAA+肝细胞与肿瘤发生发展相关
最后研究者做出总结,巨噬细胞通过侵袭区受损肝细胞分泌SAAs被特异性募集并极化。这导致了局部微环境的免疫抑制增强,并促进了肿瘤的进展。Saas的敲低抑制了肿瘤的生长,表明SAAs抑制可能是原发性和继发性肝癌的潜在治疗策略。

两篇案例都是运用单细胞转录组测序联合空间转录组研究肿瘤微环境,思路不同但最后都定位到关键细胞类型并进行验证。
从本案例可以看出,利用空转技术深入探索肿瘤扩散及转移机制需要高分辨率的空转平台、敏锐的对肿瘤边界的洞察力和过硬的生信分析能力。
单细胞转录组和空间转录组都能分析细胞间互作关系,其中空间转录组优势在于能直接在空间位置上观察细胞类型间的原位信息,同时也提示我们在研究肿瘤微环境的时候多关注肿瘤细胞和免疫细胞的关系。
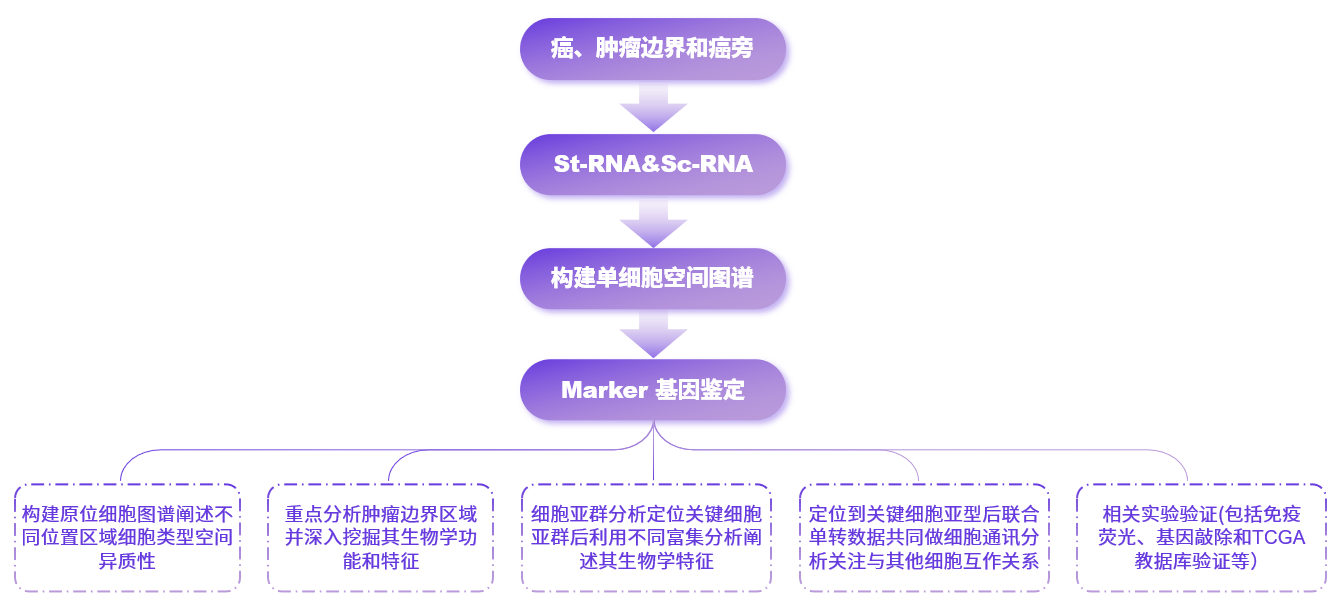
常见思路流程图
参考文献
1. Wu L, Yan J, Bai Y, Chen F, Zou X, Xu J, Huang A, Hou L J. An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression. Cell Res. 2023 Aug;33(8):585-603.

