Hi-C技术源于染色体构象捕获(Chromosome Conformation Capture—3C)技术,以整个细胞核为研究对象,利用高通量测序技术,结合生物信息学方法,研究全基因组范围内整个染色质DNA在空间位置上的关系;通过对染色质内全部DNA相互作用模式进行捕获,获得高分辨率的染色质三维结构信息,并与ATAC-seq、ChIP-seq、基因组、转录组等数据联合分析,从基因调控网络和表观遗传网络来阐述生物体性状形成的相关机制。
建库优势
动物有效数据比例可达90%以上,植物有效数据比例可达75%以上
物种经验
成功实现对人、鼠、猴、猪、牛、鸡、家蚕、拟南芥、水稻、玉米、小麦、林木等物种稳定建库
文章经验
合作文章发表于Nature、Cell等期刊,累积影响因子400+
分析软件
自主研发HiC-Pro、HiTC等信息分析软件
分析内容
实现与ATAC-seq、ChlP-seq、WGBS、RNA-seq、三代重测序等多种组学联合分析
染色质结构解析
基因表达调控
结构变异检测
癌症与疾病
植物育种
1)单个文库起始建库DNA 总量10μg;
2)单个文库对应的样本送样要求(insitu Hi-C)
| 动物细胞/文库 | 动物组织/文库 | 植物组织/文库 | 血液/文库 | 微生物/文库 |
| 5×106个细胞 | 1g组织 | 2-3g组织 | 10ml血液 | OD600值1.0-1.5的培养液50ml |
3)植物样本送样要求
新鲜活体植株上,推荐取较为幼嫩的叶片、根毛等部位,便于充分交联;如小麦等基因组较复杂,送样要求新鲜嫩叶。
4)肿瘤样本Hi-C 送样要求
物种:悬浮细胞、贴壁细胞、新鲜组织
| 样本类型 | 悬浮细胞 | 贴壁细胞 | 新鲜组织 |
| insitu Hi-C | 5×106 | 5×106 | 100mg |
| sis Hi-C | 5×104 | 5×104 | 10mg |
通过染色体重排技术建立全新核型的小鼠
A sustainable mouse karyotype created by programmed chromosome fusion
期刊:Science 发表时间:2022.8 影响因子:63.714 合作单位:中国科学院动物研究所、北京干细胞与再生医学研究院
染色体重排是指染色体发生断裂与其他染色体连接构成新的染色体。染色体重排是物种进化的重要驱动力。当前由于缺乏研究哺乳动物完整染色体重排的技术手段,在改造哺乳动物染色体技术上仍面临极大的困难和挑战,因此还需继续深入研究。
小鼠胚胎干细胞的染色体连接
利用小鼠单倍体干细胞,基于CRISPR基因编辑技术将最长的染色体1号和2号进行正反2种形式连接(Chr1+2和Chr2+1),中等长度的4号和5号染色体进行首尾连接(Chr4+5),通过染色体荧光原位杂交,核型分析,以及Hi-C等方式进一步确认了染色体的连接,同时发现染色体连接过程中可能会发生染色体的断裂和重新连接。这些结果表明两条独立存在的染色体可以通过基因编辑后非同源末端连接修复的方式连接为同一条染色体,从而实现了哺乳动物的完整染色体重排。

图1 小鼠单倍体干细胞染色体连接(A)染色体连接示意图(B)染色体连接DNA-FISH鉴定结果
染色体重排连接长度对细胞表型的影响
研究人员通过Hi-C和PacBio测序发现Chr2+1首尾融合形成的超长染色体存在较强的有丝分裂异常,携带最长染色体连接的单倍体干细胞二倍化速率显著加快,已经成为二倍体的胚胎干细胞及神经干细胞中也会发生自发多倍化。为研究上述现象,研究人员以Chr17染色体作为受体,对超长的融合染色体分别进行截断和恢复,结合染色体分离的实时观察确认了染色体长度过长是导致细胞分裂异常的原因。综上推论,哺乳动物细胞的染色体可能存在长度界限,对小鼠细胞而言,染色体长度上限范围可能在308.3Mb–377.6Mb之间。
染色体重排连接对小鼠表型产生的影响
染色体重排会对小鼠发育、行为和生殖产生多方位的影响。研究人员通过将融合改造的单倍体干细胞(Chr2+1、Chr1+2和Chr4+5)注射入卵母细胞的方式成功得到染色体连接的两类杂合半克隆小鼠。观察它们在行为和生殖能力上的差异,其中携带Chr2+1超长染色体连接的小鼠胚胎在E12.5前出现发育停滞现象;而Chr1+2及Chr1断裂后连接Chr17产生的小鼠则表现出了生长曲线和行为学的异常;携带Chr4+5中等长度染色体连接的小鼠没有表现出明显的异常,还可以继续繁殖后代产生纯合小鼠,也就证明了两条染色体的连接不会导致绝对的生殖隔离。但携带连接染色体的生殖能力明显下降。进一步探索发现,连接后的染色体虽然仍然能够与两条分离的同源染色体进行正常联会,但是联会后的同源染色体分离会出现异常。
此外,研究人员还综合分析了染色体空间结构在胚胎干细胞、神经干细胞和脑内的变化趋势,发现随着分化的进行,染色体的空间结构变化随着分化而减弱。
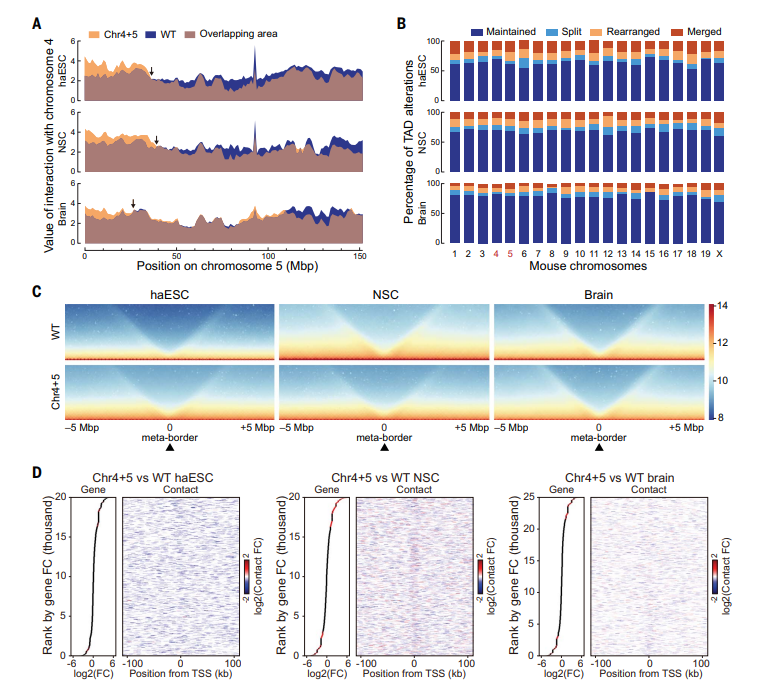
图2 染色体的空间结构变化随着分化而减弱
本研究基于PacBio测序、Hi-C等多组学技术,实现了基于实验室生物学手段,构建哺乳动物染色体重排模型,为解释染色体重排对进化的重要性、染色体形成机制,提供了技术手段。本技术有望在物种进化、生殖发育、遗传病研究中发挥重大价值。
LI-BIN Wang, ZHI-KUN LI, et al. A sustainable mouse karyotype created by programmed chromosome fusion[J]. Science, 2022.